gMSC1について
gMSC®1は現在開発中の他家由来MSCを
用いた膝軟骨再生細胞治療製品です。
従来、関節の軟骨は血管、神経、リンパ管が存在しないため、新たな細胞が供給されず、再生能力に乏しい組織と言われています。また、一旦損傷すると自然治癒が難しく、その後の経過により損傷が拡大すると変形性関節症の原因になるとも言われています。ツーセルはこの中でまず膝の軟骨損傷の治療を目標に製品開発に取り組んでいます。
gMSC®1のイメージ
gMSC®1には、“TEC”と呼ばれる移植材作製技術と、自社開発した無血清培地による培養技術、2つの特許取得技術を使っています。“TEC”は、“Tissue-Engineered Construct”の略で、「スキャフォールドフリー自己組織性三次元人工組織」という意味の移植体作製技術です。それ自身で立体的な形を作り出すことができ、
移植細胞用の人工の足場材料(スキャフォールド)を用いる必要がないため安全性が高いこと、豊富な粘着性と柔軟性をもつことから移植部の凹凸にあわせて形状を変えて密着させられることが特徴です。
移植細胞用の人工の足場材料(スキャフォールド)を用いる必要がないため安全性が高いこと、豊富な粘着性と柔軟性をもつことから移植部の凹凸にあわせて形状を変えて密着させられることが特徴です。
TECをブタ関節軟骨部欠損モデルに移植したところ、図1のようにTECは移植部に定着し、良好な軟骨再生が観察されており、有害事象も見られませんでした。また、TECは大阪大学での臨床研究によって、その有効性・安全性が確かめられています⁽¹TECを膝軟骨の損傷が認められる被験者に移植したところ、図2のように移植から48週間後には損傷していた膝軟骨部分が軟骨のような組織で覆われていることが観察されています。
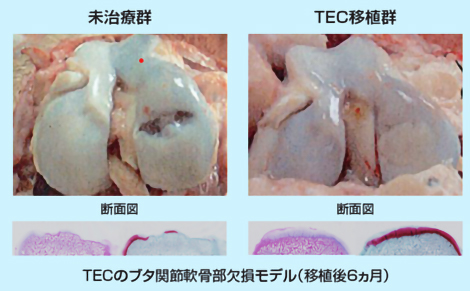 図1
図1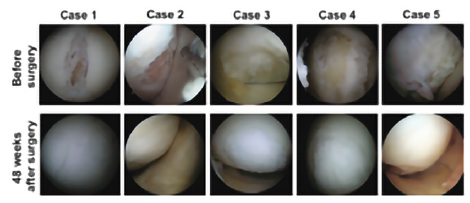 図2
図2データ提供:大阪保健医療大学、大阪大学国際医療情報センター 中村 憲正 先生
gMSC®1ではこのTEC作製技術を応用し、他家滑膜由来MSCを無血清で培養して移植体を作製していることが大きな違いです。
(1:Kazunori S., Norimasa N. et.al., The American Journal of Sports Medicine, 2018 Aug;46(10):2384-2393.
当社独自の無血清培養技術で他家MSCを培養することにより、安定して高品質な製品の大量生産が可能になり、
有効性が証明できれば多くの人の治療が可能になります。
これらの研究開発の結果、中外製薬株式会社と当該領域についてライセンス契約を締結し、2017年より臨床試験を開始しました。
また、gMSC®1の開発においては、製品を冷凍保存する技術を応用することで製造、流通及び医療現場における取り扱いの
簡便性向上を図ることとしています。

